martes, 29 de marzo de 2011
Drogas y Adicciones
martes, 22 de marzo de 2011
Didactica y TIC
El uso de las TIC es muy importante en la educacion actual ya que es mas facil interactuar con lo que nos divierte y al mismo aprender cosas nuevas que nos sirven para la vida diaria de distintas formas. Este tipo de aprendizaje se lleva a cabo con diversas actividades como subir tus aprendisajes en linea ocupar citios para interactuar asi como tambien compartir tus conocimientos con distintas personas atraves de la red.
lunes, 7 de marzo de 2011
sábado, 5 de marzo de 2011
¿Qué cambia con la concentración?

*OBSERVACIONES: En algunos productos si aplicamos alguna sustancia ya no son de la misma forma o ya no interactúan del mismo modo con alguna otra sustancia.
*PREGUNTAS DE INVESTIGACIÓN: ¿Qué cambia con la concentración?
*PLANTEAMIENTO DEL PROBLEMA: COMPROBAR LA DIFERENCIA DE DNSIDAD ENTRE EL AGUA DULCE Y EL AGUA SALADA.
*HIPOTESIS: Sal juntar estas materias se hace una reacción química
*MARCO TEORICO:
NO! Cualquier sal (incluso la sal común: esta conformada de dos iones: El catión metálico, por ej. Na+, y el anión, por el Cl-.
Al disolver la sal en agua, lo que sucede es que las uniones que mantienen unidos los cristales de la sal se rompen, quedando los iones por separado en el liquido. La razón para esta ruptura es que la atracción que sienten los iones por separados (Na+ y Cl-) por el agua (que es una molécula polar) es superior a la atracción que sienten los iones entre si para formar la sal.
*EXPERIMENTAR:
Materiales:
Dos vasos
Agua
Sal
Una cuchara
Dos limones
Procedimiento:
1) Llenar dos vasos con agua al mismo nivel
2) Agregar tres cucharadas grandes de sal a uno de dos vasos y agitar con la cuchara hasta que la sal se disuelva por completo
3) Coloca un limón en cada vaso y observa. Llena la tabla con tus observaciones.
MUESTRA OBSERVACIONES
Vaso con agua y sal Flota el limón y no se hunde.
Vaso con agua El limón se hunde y no flota
*RESPUESTAS:
Análisis de los resultados.
o ¿Por qué el limón flota en uno de los vasos y en el otro no? R:por que la sal hace que la densidad del agua suba
o ¿Qué propiedad es la que esta cambiando en cada vaso? ¿Por qué? R: la densidad; por que la densidad de la sal hace que el limón flote.
o ¿Qué ocurriría si agregamos mas sal? R: flota mucho más el limón.
MEDIDAS DE SEGURIDAD DE LABORATORIO

1) Utiliza una bata y tenla siempre bien abrochada, así protegerás tu ropa.
2) No lleves bufandas, pañuelos largos ni prendas u objetos que dificulten tu movilidad.
3) Procura no andar de un lado para otro sin motivo y, sobre todo
, no corras dentro del laboratorio.
4) Si tienes el cabello largo, recógetelo.
5) Dispón sobre la mesa sólo los libros y cuadernos que sean necesarios.
6) Ten siempre tus manos limpias y secas. Si tienes alguna herida, tápala.
7) No pruebes ni ingieras los productos.
8) En caso de producirse un accidente, quemadura o lesión, comunícalo inmediatamente al profesor.
9) Recuerda dónde está situado el botiquín.
10) Antes de manipular un aparato o montaje eléctrico, desconéctalo de la red eléctrica.
11) No pongas en funcionamiento un circuito eléctrico sin que el profesor haya revisado la instalación.
12) No utilices ninguna herramienta o máquina sin conocer su uso, funcionamiento y normas de seguridad específicas.
13) Maneja con especial cuidado el material frágil, por ejemplo, el vidrio.
14) Informa al profesor del material roto o averiado.
15) Fíjate en los signos de peligrosidad que aparecen en los frascos de los productos químicos.
16) Lávate las manos con jabón después de tocar cualquier producto químico.
17) Al acabar la práctica, limpia y ordena el material utilizado.
18) Si te salpicas accidentalmente, lava la zona afectada con agua abundante. Si salpicas la mesa, límpiala con agua y sécala después con un paño.
19) Evita el contacto con fuentes de calor. No manipules cerca de ellas sustancias inflamables.
“Obtención de oxigeno”
Sistema cerrado
Matraz
Tina
Madera
Fósforos
Sustancias:
Agua oxigenada (H_2 O_2)
Agua
Hígado
Observaciones:
El oxigeno es un elemento que se puede sacar de barios productos compuestos para poder utilizarlo en hospitales, aviones etc. Para poder sacar el oxigeno tendremos que aplicar un método para poder sacar el oxigeno de las mezclas.
Preguntas de investigación:
¿Cómo sacar el oxigeno de agua oxigenada?
Planteamiento del Problema:
Saber como sacar el oxigeno de agua oxigenada
Hipótesis:
Esta se evapora al hacer reacción con el hígado y sale del agua oxigenada.
Marco teórico:
Existe un método que es por electrolisis, partiendo de que el agua esta formada por hidrogeno y oxigeno, introduces en esta dos electrodos de alto voltaje de CD, este efecto separa las moléculas de ambos elementos, pero no es nada sencillo, en la red puedes encontrar sistemas para producir pequeñas cantidades, debes tomar en cuenta que ambos elementos por separado pueden ser peligrosos, el hidrogeno es altamente explosivo y el oxigeno también si se mezcla con grasa, si lo requieres para algún proceso mas industrial pues este lo venden en ampolletas especiales.
Experimentacion:
Se hace un sistema cerrado con una botella colocando una manguera por la tapa haciendo que no salga aire por ninguno orificio, luego el la tina se coloca un poco de agua para que luego el matraz lleno de agua se volte quedando de cabeza dentro de la tina con la manguera dentro.
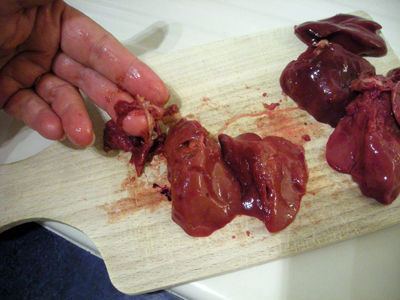
Se coloca el higado en partes dentro de la bottela rpidamente se vierte el agua oxigenada y se cierra, bombeando la botella podemos observar como el higado hace reaccion con el agua oxigenada y el higado se desace poco a poco el agua del matraz se sale mientras en oxigeno entra con la madera caliente se mete con rapides dentro del matraz comprobando que si la madera se prende hay oxigeno dentro del matraz y cuando se apaga lo unico que queda es bioxido de carbono.
Respuestas:
La reacción del agua oxigenada con el hígado causo que el oxigeno saliera en estado gaseoso.
“CAMBIO QUÍMICO”
Material:
Cerillos
Soporte universal
Pinzas
Tubo de ensayo
Vidrio de reloj
Vela
Sustancias:
Agua
Carburo de calcio
Observaciones:
A la hora de mezclar agua con carburo de sodio este hacia reacción y comenzaba a sacar vapor el cual a tener contacto con el fuego de mantenía durante un momento como si fuera la función de una estufa.
Preguntas de investigación:
¿Qué hace reaccionar al carbura de calcio para lograr una flama al contacto con el fuego?
Planteamiento del Problema:
Saber por que el carburo y el agua provocan ese humo y que tiene o de donde se posee el carburo de calcio.
Hipótesis:
Ya que al juntar agua con carburo de calcio provoca una fermentación y así logra sacar por medio del vapor una sustancia o un elemento parecido al helio para que logre prender con el fuego.
Marco teórico:
El carburo de calcio es una sustancia sólida de color grisáceo que reacciona exotérmicamente con el agua para dar cal apagada (hidróxido de calcio) y acetileno.
Es de uso muy extendido y vendido en tiendas del ramo para utilizarlo en soldadura autógena. Con esta finalidad se lo introduce en un gasógeno, que le va agregando agua lentamente, y luego se mezcla el gas producido con oxígeno para producir una llama delgada y de alta temperatura
Fosfatos que suelen estar presentes como impurezas en los materiales de partida dan en las mismas condiciones fosfuro de calcio (Ca3P2) que reacciona igualmente con el agua dando fosfina (PH3). Esta impureza además de trazas de sulfhídrico (H2S) y amoníaco (NH3) es responsable del mal olor a "carburo".
Experimentación:
En el soporte universal se coloca el tuvo de ensayo con agua para luego colocarle poco a poco el carburo del calcio que se colocaría en el vidrio de reloj este hace reacción poco a poco creando una nube color blanco. Se acerca la vela encendida y al tener contacto estas provocan una flama pequeña y delgada, no dura mucho tiempo.

Respuestas:
La reacción entre el agua el carburo de calcio es tan grande que a la hora de acercar la flama o el calor hace otra reacción mas fuerte y provoca una pequeña y delgada flama.
Ecuación química
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción

El símbolo "+" se lee como "reacciona con", mientras que el símbolo "→" significa "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos.
Balanceo de ecuaciones químicas
Definición: Balancear una ecuación química es igualar el número y clase de átomos, iones o moléculas reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa.
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas para indicar la cantidad de elementos o compuestos que intervienen en la reacción química. No deben confundirse con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia. Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
Para balancear una ecuación química, se debe considerar lo siguiente:
* Conocer las sustancias reaccionantes y productos.
* Los subíndices indican la cantidad del átomo indicado en la molécula.
* Los coeficientes afectan a toda la sustancia que preceden.
* El hidrógeno y el oxígeno se equilibran al final, porque generalmente forman agua (sustancia de relleno). Esto no altera la ecuación, porque toda reacción se realiza en solución acuosa o produce sustancias que contienen agua de cristalización.
viernes, 4 de marzo de 2011
la ley del octeto
La ley del octeto en Química es la ley que dice que todo átomo busca su estabilidad; esta estabilidad la busca completando sus OCHO (de ahí OCTeto) electrones de valencia. Los electrones de valencia son los electrones que los átomos usan para compartir con otros átomos y así formar enlaces covalentes, ó perder o ganar más para formar un enlace iónico. los átomos tienen hasta ahora 7 niveles de energía como máximo, donde sus electrones (todos, no sólo los de valencia) se acomodan y están en movimiento. No todos los átomos tienen 7, pueden tener menos. Los electrones de valencia se encuentran en el nivel más alto. Para que un electrón complete su octeto debe tener su último nivel de enrgía completo, y por consiguiente, los demás también deben estar completo. En síntesis, para completar el octeto el átomo debe tenr completos sus niveles de energía. Hay elementos cuyos átomos ya tienen completo su octeto por naturaleza, como es el grupo de los gases nobles (8A.. la ultima columna a la derecha de la tabla periódica).
El número de valencia ó número de oxidación es el número de electrones de valencia que tiene completados el átomo.. por ejemplo, si trabaja con el número -2 es que tiene 2 electrones libres en su último nivel.
LA TABLA PERIODICA

La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev, fue diseñada por Alfred Werner.
John Alexander Reina Newlands
John Alexander Reina Newlands (26 de noviembre de 1837 - 29 de julio de 1898) fue un químico analítico inglés que preparó en 1864 una tabla periódica de los elementos establecida según sus masas atómicas, y que señaló la 'ley de las octavas' según la cual cada ocho elementos se tienen propiedades similares. A esto lo ayudó su bagaje musical. Fue ridiculizado en ese tiempo, pero cinco años después el químico ruso Dimitri Mendeleiev publicó (independientemente del trabajo de Newland) una forma más desarrollada de la tabla, también basada en las masas atómicas, que es la base de la usada actualmente (establecida por orden creciente de números atómicos.
la tabla periodica
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev, fue diseñada por Alfred Werner.
La ley del octeto en Química es la ley que dice que todo átomo busca su estabilidad; esta estabilidad la busca completando sus OCHO (de ahí OCTeto) electrones de valencia. Los electrones de valencia son los electrones que los átomos usan para compartir con otros átomos y así formar enlaces covalentes, ó perder o ganar más para formar un enlace iónico. los átomos tienen hasta ahora 7 niveles de energía como máximo, donde sus electrones (todos, no sólo los de valencia) se acomodan y están en movimiento. No todos los átomos tienen 7, pueden tener menos. Los electrones de valencia se encuentran en el nivel más alto. Para que un electrón complete su octeto debe tener su último nivel de enrgía completo, y por consiguiente, los demás también deben estar completo. En síntesis, para completar el octeto el átomo debe tenr completos sus niveles de energía. Hay elementos cuyos átomos ya tienen completo su octeto por naturaleza, como es el grupo de los gases nobles (8A.. la ultima columna a la derecha de la tabla periódica).
El número de valencia ó número de oxidación es el número de electrones de valencia que tiene completados el átomo.. por ejemplo, si trabaja con el número -2 es que tiene 2 electrones libres en su último nivel.
jueves, 3 de marzo de 2011
Enlaces quimicos
¿Qué entiendo por átomo?
Esta formado un núcleo de carga positiva, donde concentra casi toda la masa del átomo, su tamaño es muy pequeño; está formado por protones y neutrones, en conjunto conocidos como nucleones; alrededor del núcleo se encuentra una nube de electrones de carga negativa llamada envoltura, su masa es muy pequeña, su tamaño en general, es muy grande.
Conocimiento: El átomo es lo que forma las materias. Este esta formado por electrones (+), protones (-) y neutrones. Se puede cargar de forma negativa o positiva dependiendo de sus electrones de valencia. Así denominándolo como catión o anión. A los átomos cargados se les conoce como iones.
¿Qué es un enlace químico?
Un enlace químico es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeto
Proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos.
En general, el enlace químico fuerte está asociado con la compartición o transferencia de electrones entre los átomos participantes.
Las moléculas, cristales, y gases diatónicos -o sea la mayor parte del ambiente físico que nos rodea- está unido por enlaces químicos, que determinan la estructura de la materia.
¿Cómo se da un enlace covalente?
Decimos que son covalentes cuando los átomos comparten electrones para completar los 8 y cumplir con la regla del octeto. El enlace covalente puro: ejemplo el hidrogeno que solo tiene un electrón y para que sea estable tiene que tener 2 en el primer nivel para esto se une con otro átomo de hidrogeno y así comparten su electrón para que ambos tengas 2.
¿Cómo se hace un enlace iónico?
En una unión de dos átomos por enlace iónico, un electrón abandona el átomo menos electronegativo y pasa a formar parte de la nube electrónica del más electronegativo
.
El cloruro de sodio (la sal común) es un ejemplo de enlace iónico: en él se combinan sodio y cloro, perdiendo el primero un electrón que es capturado por el segundo:
Na+Cl → NaCl
miércoles, 2 de marzo de 2011
¿Qué estudia la química?
Química es la ciencia que estudia la estructura, propiedades y transformaciones de la materia a partir de su composición atómica.

Aunque hay una gran variedad de ramas de la química, las principales divisiones son:
Química Orgánica
Química Inorgánica
Fisicoquímica
Química analítica
Bioquímica
Antoine Lavoisier, considerado el padre de la química moderna.




